Атом құрылысы
Заттың атомдық құрылымы туралы болжамдар біздің дәуірімізге дейін де пайда болды. Ежелгі Шығыс пен Ежелгі Грецияның ойшылдары бүкіл Әлемді құрайтын өте кішкентай, тіпті бөлінбейтін материалдық бөлшектердің болуы туралы ойларын білдірді.
Ең танымалы – ежелгі грек философы Демокриттің теориясы. Бөлінбейтін дегенді білдіретін аtomos терминін алғаш енгізген ол. Демокрит дүниедегі барлық нәрсе атомдар мен бостықтан тұрады, атомдар мәңгі бар, оларды ешкім жаратпаған, олар материалдық, пішіні, өлшемі және салмағы бар деп есептеді. Атомдардың денелерге қосылуы ілгектер мен ілмектердің көмегімен жүзеге асады. Адамның жаны да пішіні тегіс атомдардан тұрады. Бостықтағы атомдар тек түзу сызықпен қозғалады, сондықтан адамда еркіндік жоқ, бәрі алдын ала белгіленген.
Демокриттің шәкірті Эпикур бұл ілімді жетілдірді және атомдар өздігінен түзу жолдан ауытқи алады, сондықтан адам әлі де еркіндікке ие болады деп болжайды.
Атом – бұл элементар заттың ең кіші құрылымдық элементі, яғни бірнеше элементтердің қосылуынан тұрмайтын зат. Атом ядродан және атом қабығынан тұрады. Атом ядросы бірнеше протондар мен нейтрондардан тұрады (сутегі жағдайында – тек бір протоннан), ал атом қабығы бірнеше электрондардан (сутегі жағдайында – бір электроннан) тұрады. Протондар саны әрқашан бейтарап күйдегі электрондар санына тең. Егер Сан сәйкес келмесе, онда элемент Атом емес, электр зарядталған ион.
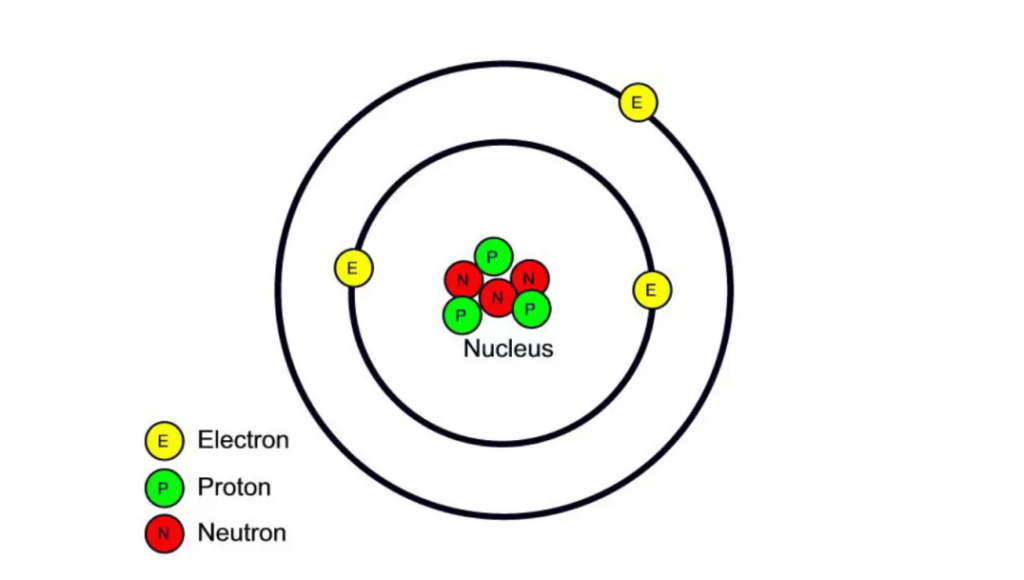
Литий атомының моделі. Қабық моделіндегі электрондардың траекториялары көрсетілген.
Атом дегеніміз не
Заманауи ғылым атомды мөлшері мен массасы бойынша өте кішкентай, химиялық элементтің ең кішкентай бөлігі болып табылатын және оның химиялық қасиеттерінің тасымалдаушысы ретінде әрекет ететін заттың бөлшегі ретінде анықтайды.
Барлығы 118 атом белгілі, оның 94-і табиғатта кездеседі, ал қалған 24-і ядролық реакторлар мен лабораторияларда жасанды түрде синтезделген.
Атомдардың белгілі бір массасы, мөлшері және құрылымы болады. Атомдардың массасы өте аз. Мысалы, сутегі атомының массасы небәрі 1,67 х 10-24 г. Атомның салмағы әдетте атомдық масса бірліктерімен өлшенеді. Осындай бір бірлік көміртегі атомының массасының 1/12 бөлігіне тең, оның ядросында 6 нейтрон және 6 протон бар. Сонымен 1.00 атомдық масса бірлігі = 1 нейтрон = 1 протон. Мысалы, сутегі атомының ядросы 1 протоннан тұрады, сондықтан оның массасы 1 атомдық масса бірлігі.
Атомдардың өлшемдері де шағын және 0,046-0,25 нм (1 нм = 1 м-9) аралығында болады.
Атомның құрамы
Атомдар ядро мен электрондардан тұрады, оларды кейде «электрондық бұлт» деп те атайды. Атом ядросы протондар мен нейтрондардан тұрады.
- Электрон (1897 жылы ашылған гректің кәріптас деген сөзінен шыққан) теріс зарядты бөлшек. Электрондар электронды қабаттар арқылы қозғалады.
- Протон (грек тілінен – бірінші, 1919 жылы ашылған) – оң зарядты ядролық бөлшек.
- Нейтрон (1932 жылы ашылған латын тілінен «бірі де, екіншісі де») — заряды жоқ ядролық элемент.
Протондар мен нейтрондар бірге нуклондар (ядролық бөлшектер) деп те аталады.
Протондар санына байланысты атомның Менделеевтің периодтық жүйесінде сәйкес саны бар және белгілі бір химиялық элементке жатады атом ядросындағы нейтрондардың саны берілген элементтің изотопын көрсетеді. Изотоптар – атомдық нөмірлері бірдей, бірақ массалары әртүрлі бір химиялық элемент атомдарының сорттары.
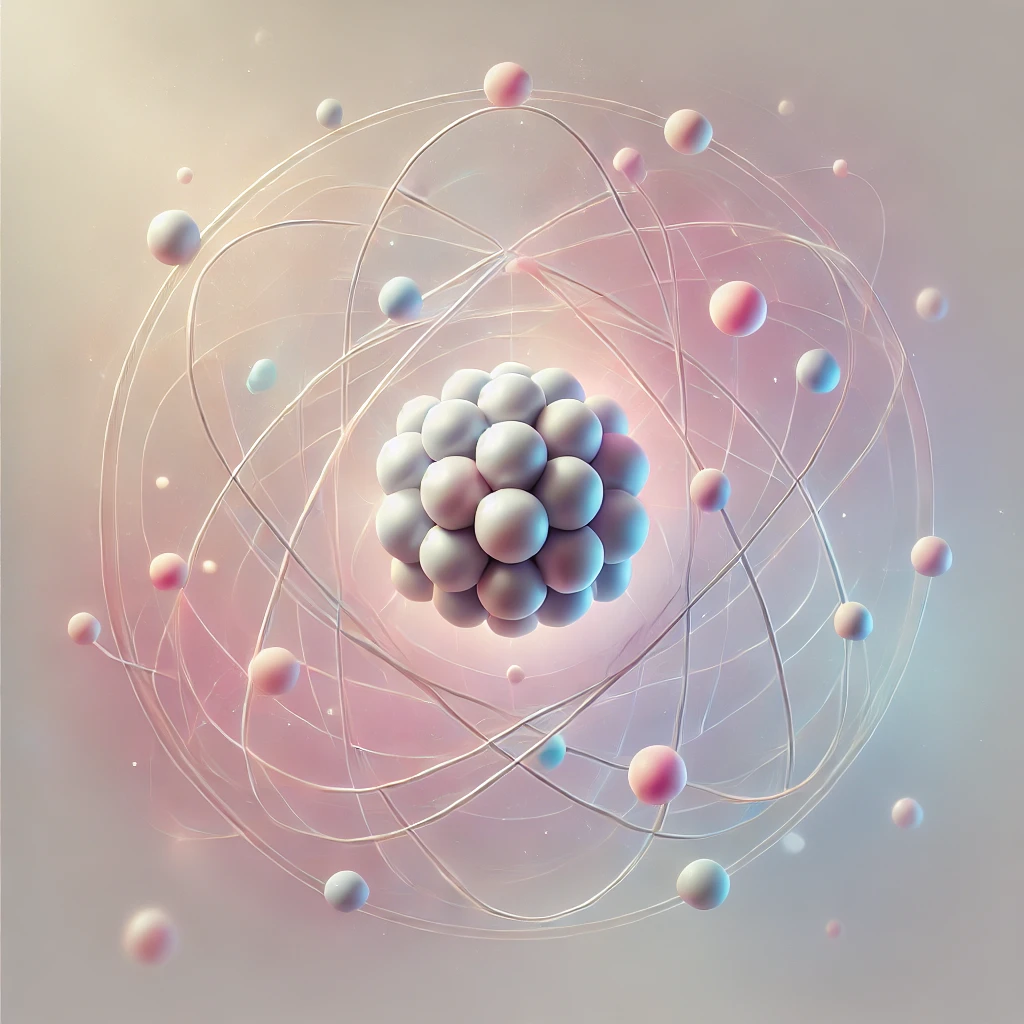
Атом құрылымының электрондық схемасы
Атом электрлік бейтарап, өйткені ядродағы оң заряд ядроны айналып өтетін электрондардың теріс зарядтарының қосындысына тең. Олардың қозғалысы электронды қабықшалар бойымен жүреді. Электрондар мен электронды қабаттардың саны атом ядросының зарядына байланысты.
Химиялық элементтердің периодтық жүйесінде атомдардың құрылымы анық көрсетілген. Мысал ретінде натрий химиялық элементін алайық. Элемент таңбасы латын әріптерімен (Na) белгіленген.
Атомдық нөмір (Z) – атомдағы протондар мен электрондар саны (Na – 11 үшін).
Na үшін қабаттар бойынша электрондардың таралуы 2, 8, 1.
Элементтің атомдық массасы (атомдық масса, салыстырмалы атомдық масса) – атомдағы нейтрондардың, протондардың және электрондардың амумен көрсетілген жалпы массасы. Na кезінде бұл 22,99.
Na атомының электрондық конфигурациясы былай жазылады: 1s2 2s2 2p6 3s1, мұндағы 1s – s-электрондық орбитальда 2 электрон орналасқан бірінші энергетикалық деңгей; 2s және 2p – екінші энергетикалық деңгей, мұнда s-электрондық орбитальда 2 электрон және p-электрондық орбитальда 6 электрон бар; 3s – үшінші энергетикалық деңгей, мұнда s-электрондық орбитальда 1 электрон бар.
Атомдар құрылымының модельдері
Ғылым тарихында атом құрылысының әртүрлі үлгілері жасалды. 1803 жылы Джон Далтон атомды бұзылмайтын ең кішкентай материалдық сфера ретінде бейнелейтін сфералық модельді ұсынды.
1904 жылы Джозеф Томпсон «Мейіз пудингі» деп аталатын модель жасады. Бұл модельде атом өз ішінде теріс зарядталған электрондары бар нақты оң зарядталған дене ретінде қарастырылды.
1911 жылы Эрнест Резерфорд өз тәжірибелеріне сүйене отырып, атом шағын планеталық жүйеге ұқсайды деген қорытындыға келді, онда электрондар ядро айналасында орбита бойынша айналады. Дегенмен, планетарлық модель классикалық электродинамика принциптеріне қайшы болды, оған сәйкес қозғалатын электрондар энергияны жоғалтып, ядроға түсуі керек.
Нильс Бор келесі толықтыруларды енгізу арқылы атомның планетарлық моделін жетілдірді:
- әрбір электрон ядроның айналасында тек қатаң белгіленген стационарлық орбиталарда айнала алады;
- мұндай айналу кезінде атом энергия шығармайды;
- энергияның эмиссиясы немесе жұтылуы атом бір стационарлық күйден екіншісіне өткенде ғана болады.
Атомның қазіргі моделі кванттық механикалық деп аталады. Ол Вернер Гейзенбергтің белгісіздік және комплементарлық принциптерін пайдаланады, оған сәйкес электрон әрі бөлшек, әрі толқын болып табылады, анықталған орбиталар жоқ, электрондар ядроны айналып электрон бұлттарын құрайды.










